| Epigenetik modifikasyonlar kalıtsaldır, gelecek nesillere taşınır, çevresel etkilerle değişir. Hücre bölünmesiyle epigenetik durum korunur. Epigenetik durum çevre koşulları, beslenme, kimyasal ve radyasyona maruz kalma, çeşitli hastalıklar gibi çevresel etkilerle değişir ve geri dönüşümlüdür. Epigenetik modifikasyonları 3 ana başlıkta toplayabiliriz.
Epigenetik modifikasyonlar kromatin yapısını değiştirerek gen ekpresyonunu baskılayıcı veya aktive edici özellikler gösterirler.
|
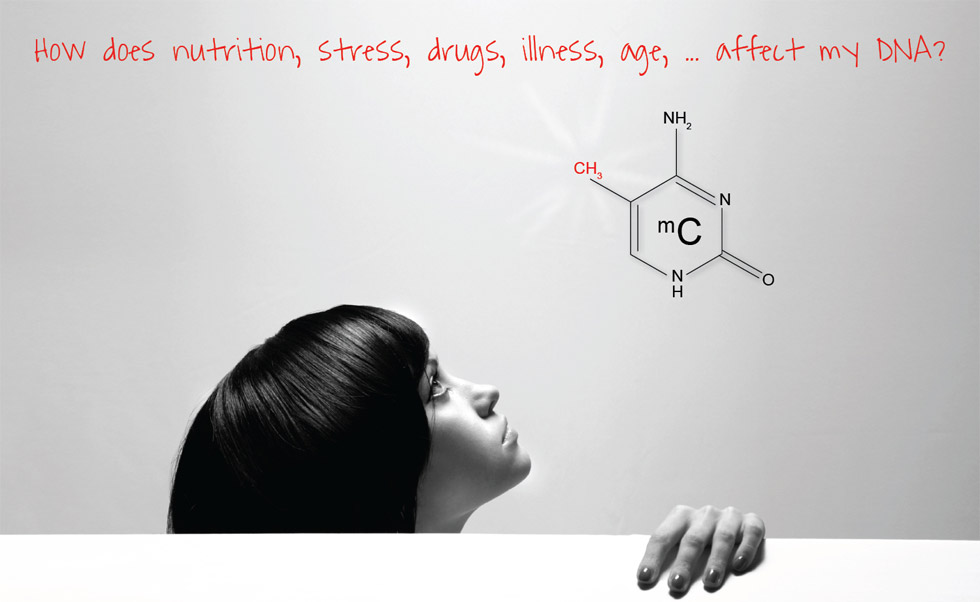
DNA METİLASYONU
DNA baz diziliminde guaninden önce gelen sitozinin 5. karbonuna bir metil (CH3) grubunun bağlanması metilasyon olarak adlandırılmaktadır.
|
Araştırma Alanları
Tümör baskılayıcı genlerin promotor bölge metilasyonu ve onkogenler üzerindeki metilasyon kaybı kanser teşhis ve gelişim süresinde önemli ve tetikleyici rol oynamaktadır. Mutasyon öncesinde ortaya çıkan metilasyon kanserin erken teşhisi için önemli bir parametredir.
İstisnalar: X kromozom inaktivasyonu İmprite genler Doku spesifik genler |
DNA METİLASYONU VE GEN EKPRESYONU Metillenmiş DNA Gen Ekspresyonunu 2 yolla etkiler.
(Örneğin RNA polimerazı uzaklaştıran proteinler ve HDAC) | |
DNA METİLASYONU VE KANSER
Kanser kontrolsüz hücre bölünmesidir. Kanser hücresinde DNA metilasyon paternleri değişir.
| |
GLOBAL DNA HİPOMETİLASYONU
Hücreyi kansere götürür.
| |
TÜMÖR SUPRESSÖR GEN HİPERMETİLASYONU
| |
KANSER TERAPİSİ
ile susan Tumor Supressor Genlerin yeniden aktivasyonu amaçlanmaktadır.
| |
DNA Metilasyonu Ölçüm Teknikleri | |
| DNA Metilasyonu ölçümü için günümüzde birçok yöntem kullanılmaktadır. Geliştirilen sistemlerle gen bölgesi bazında ve bütün bir genomun metilasyon statüsünü ölçmek mümkündür. Çoğu metilasyon ölçüm tekniği sodium bisülfit treatment yöntemiyle bisülfit modifikasyonu yapılmış DNA numunesini kullanmaktadır. |
| |
DNA BİSÜLFİT MODİFİKASYONU
Metilasyon ölçümü için bisülfit modifikasyonu yöntemi gold standart olarak kabul edilmektedir. Bu yöntemde DNA baz diziliminde metillenmemiş olan tüm sitozin bazları kimyasal reaksiyonla urasil’e dönüştürülür. Metile olan sitozinler etkilenmez, sitozin olarak kalır.
Bisülfit modifikasyonu yapılan DNA end-point PCR, RT-PCR, sekans, Cobra, ChIP, mikroarray gibi yöntemlerde kullanılır.
DNA Bisülfit modifikasyon kitleri ile DNA nın bisülfit conversiyonu %%99,0 - 99,5 conversiyon etkinliği ile 1,5-3,5 saatte gerçekleştirilir, bisülfit atıklarından arındırılmış purifie DNA elde edilir.
Region-Specific DNA Methylation Analysis kitleri ile herhangi bir gen bölgesinde bisülfit modifikasyonu yapmadan RT-PCR ile metilasyon yüzdesi quantitative olarak elde edilir.
5mc Elisa kiti ile DNA nın global metilasyon yüzdesi ölçülür.
Zymotaq polymerase MSP PCR için eşsiz metilasyon spesifik TAQ polimerase enzimidir. GC yönünden zengin, bisülfit modifikasyonu yapılmış DNA yı amplifie özelliği var ve hotstart. Enzim DNT miks de içermektedir
HİSTON MODİFİKASYONLARI
Histon Modifikasyonları Histonlarda meydana gelen acetylation, methylation, phosphorylation, ubiquitination ve sumoylation gibi modifikasyonlar kromatin yapısını değiştirerek gen anlatımını regüle eden epigenetik mekanizmalardandır. En iyi karakterize edilen histon modifikasyonları asetilasyon ve metilasyon’ dur.
Histon Asetilasyonu Histon proteinlerinin N-terminal tırnaklarının lysine(K) resudelerinde oluşur. Nükleozom yapısını gevşeterek transkripsiyon faktörlerinin DNA’ya ulaşmasını sağlar, aktif gen anlatımına neden olur. Histon acetlytransferases(HAT) ve Histon Deacetlylases(HDAC) histonlara asetil gruplarının eklenmesi ve çıkarılmasını katalaz eden enzimlerdir.
Histon Metilasyonu Histon proteinlerinin N-terminal tırnaklarının lysine(K) ve arginine(R) resudelerinde tekli, double veya trible olarak oluşur. Ortaya çıktığı yere göre transkripsiyonel aktivite veya baskılamaya neden olur. Histon methyltransferase (HMT) ve histon demethylase (HDM) enzimleri ile regüle edilir.
|
Histon Acetylation Histon Methylation Phosphorylation Ubiquitination Sumoylation |
KROMATİN YAPISI | |
|
|

Epigenetik, DNA sekansını değiştirmeyip DNA, protein ve RNA’ların fonksiyonunun ve regulasyonunun değişimi ile sonuçlanan modifikasyonları içerir. Embriyo sürecinden itibaren epigenetik patern hücreye ve dokuya özgü olarak gelişmektedir...

Bakteri ve virüsler arasındaki en önemli farklardan biri hayatta kalmak ve çoğalmak için kullandıkları yöntemlerdir. Bakteriler DNA, ribozom, sitoplazma, hücre duvarı ve hücre zarına sahip tek hücreli canlılardır...

Ultra hassas kana özgü qPCR master mixleri kullanarak kanseri tespit edin

İdrar örneklerinden cinsel yolla bulaşan hastalıklar, idrar yolu enfeksiyonları, tropikal hastalıklar veya kanser testi için ideal

Transfüzyon için kullanılacak tüm kan, HIV, Hepatit B & C, HTLV, Frengi, Zika ve Batı Nil virüsü gibi bazı bulaşıcı hastalıkları için test edilir. Kan aktarımını güvenli tutmak için tarama çözümleri, enfeksiyonun çok erken aşamalarında patojenleri tespit edebilmelidir.

Quick-16S™ NGS Library Prep Kit, 16S rRNA amplifikasyonu için uç nokta PCR yerine gerçek zamanlı PCR kullanır, bu da PCR ürünlerinin doğrudan nicelleştirilmesine olanak tanır ve TapeStation® analizi veya jel elektroforezi gibi ek kitaplık niceleme analizine olan ihtiyacı ortadan kaldırır.

Quick-ITS Plus NGS Library Prep Kiti , yüksek verimli dizileme için ITS bölgesini hedefleyen en hızlı ve en basit NGS kütüphane hazırlığıdır. Otomasyon dostu protokol, özel olarak tasarlanmış primerler kullanılarak birleştirilmiş hedeflenen amplifikasyon ve barkod ekleme için tek bir qPCR/PCR kullanır.
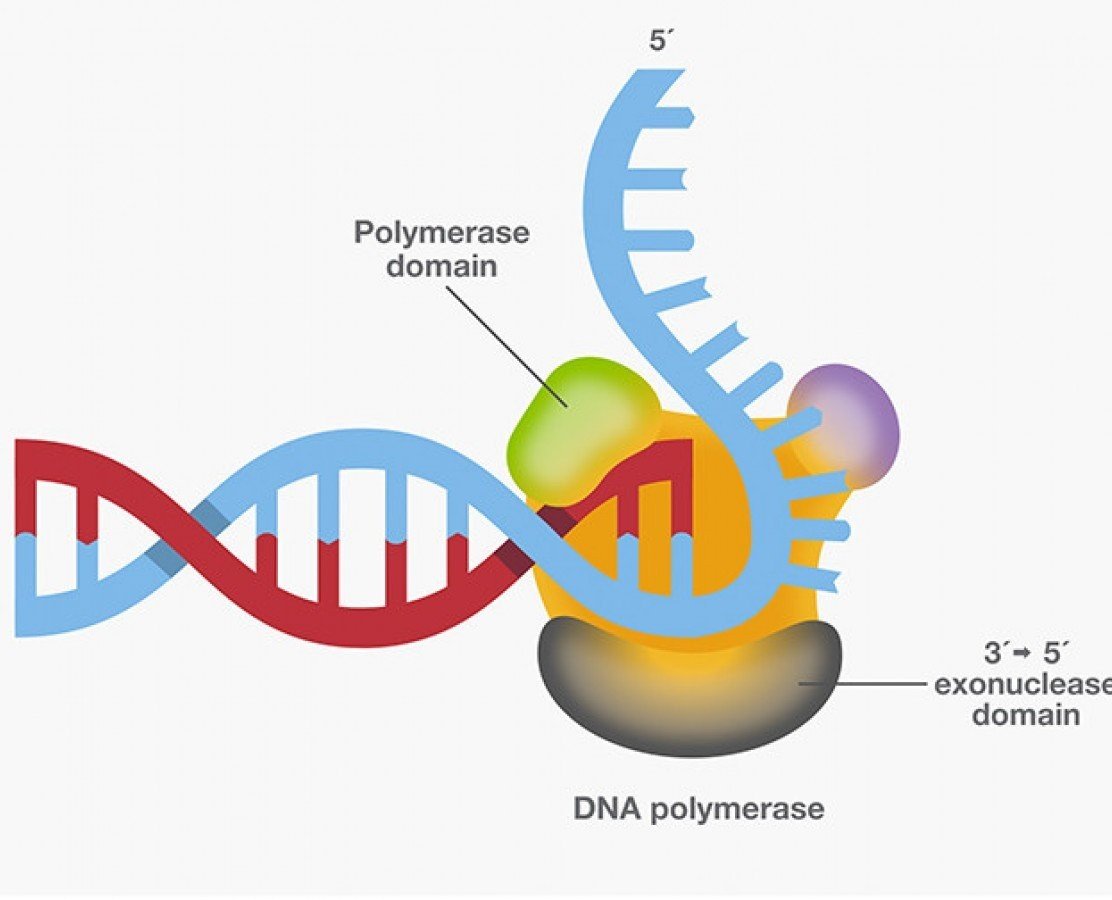
Başarılı PCR iki kritik bileşime bağlıdır. En iyi sonucu verecek şekilde optimize edilmiş reaksiyon buffer ve yüksek kaliteli thermostable DNA polymerase (Taq DNA polymerase gibi)….

DNA’nın metilasyon statüsünü belirlemek için sodium bisulfite treatment yöntemi gold standart olarak kabul edilmektedir.

Bir Metagenomik dalı olarak bilinen Mikrobiomik, her bir mikroorganizmanın tüm genomunun sekanslanmasıyla günümüzde moleküler biyolojiyi kökten değişime uğratmıştır. Kendi doğal ortamlarında mikroorganizmaların genomlarına direk ulaşılmasıyla birlikte metagenomik, çevresel çalışmalara biyomarker araştırmalarında olduğu kadar uygulanmış ve mikrobiyal çeşitlilik çalışmaları için yeni bir dönem başlatmıştır.

Gen anlatımı, DNA'nın protein yapmak için kullanıldığı ve daha sonra vücutta çeşitli önemli işlevleri yerine getirmeye devam ettiği süreçtir. Proteine örnek olarak bir enzim, hormon veya reseptör gösterilebilir. Gen ifadesi süreci aşağıdaki adımları içerir:
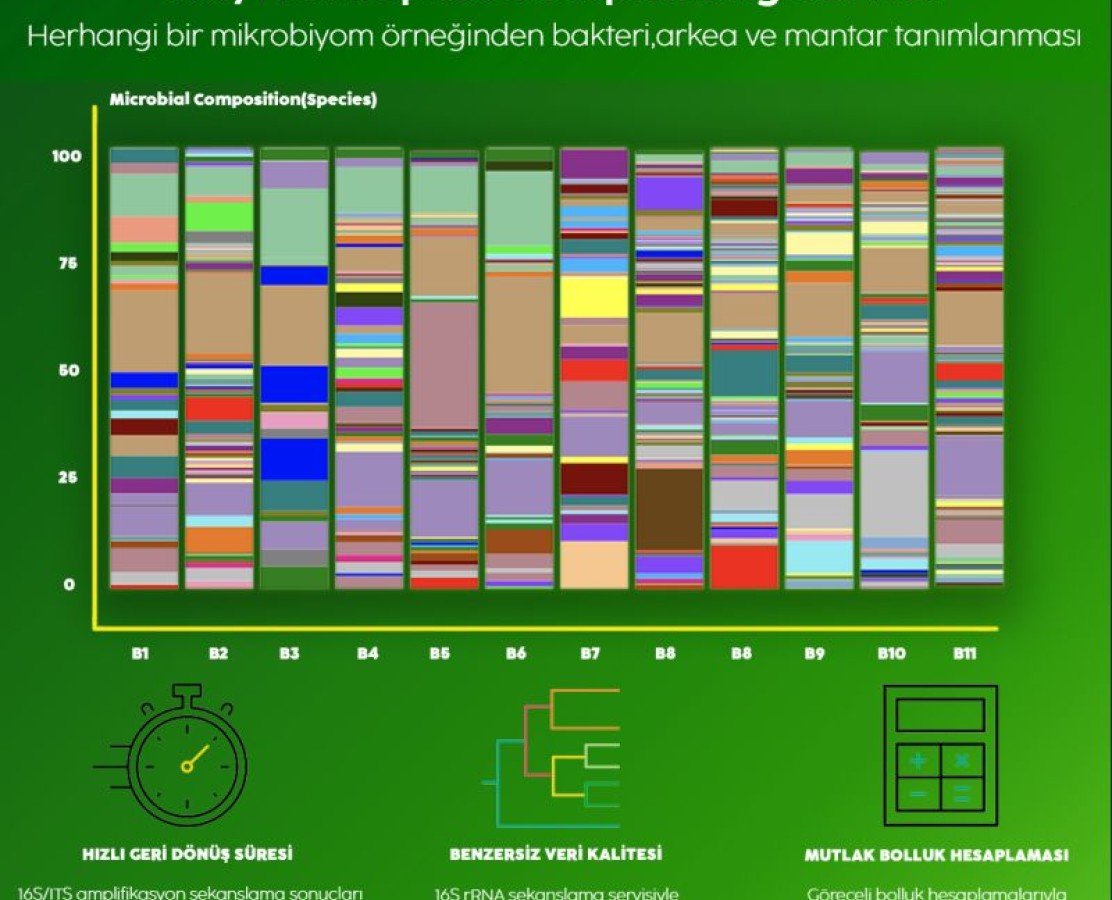
Bir Metagenomik dalı olarak bilinen Mikrobiomik, her bir mikroorganizmanın tüm genomunun sekanslanmasıyla günümüzde moleküler biyolojiyi kökten değişime uğratmıştır. Kendi doğal ortamlarında mikroorganizmaların genomlarına direk ulaşılmasıyla birlikte metagenomik, çevresel çalışmalara biyomarker araştırmalarında olduğu kadar uygulanmış ve mikrobiyal çeşitlilik çalışmaları için yeni bir dönem başlatmıştır.