Genin promotor bölge veya herhangi bir bölgesindeki metilasyon durumunu ölçmek için;
DNA’nın metilasyon statüsünü belirlemek için sodium bisulfite treatment yöntemi gold standart olarak kabul edilmektedir. Hem kolay hem de efektif bir yöntemdir. Bu yöntemle DNA’daki metillenmemiş tüm sitozinler kimyasal reaksiyonla Uracil’e çevrilir. DNA’daki metillenmiş olan sitozinler reaksiyon süresince değişmeden kalır. Dönüşüm işlemi bittikten sonra DNA PCR ile amplifiye edilir ve sekanslama işlemi yapılarak DNA’nın metilasyon statüsü belirlenir. Sekanslama esnasında Uracile çevrilen metillenmemiş sitozinler timin olarak, metillenmiş sitozinler ise sitozin olarak ölçülür. Bisülfit dönüşümü yapılan DNA: MSP,COBRA, SNuPE, Qmsp, HRM, MassArray gibi farklı tekniklerde kullanmak için de uygundur.
DNA Bisülfit modifikasyonu sonrası şu işlemlerle metilasyon ölçebilirsiniz.
DNA nın bisülfit modifikasyonunu yapıp sonrasında end-point gel PCR yapabilirsiniz. Bu durumda metilasyon var veya yok şeklinde sonuç alırsınız.
DNA nın bisülfit modifikasyonunu yaptıktan sonra RT-PCR ile analiz edip, kantite edebilirsiniz.
DNA nın bisülfit modifikasyonunu yaptıktan sonra sekans yapıp, hangi sitozinlerin metile hangi sitozinlerin unmetile olduğunu ortaya koyabilirsiniz.
MSP PCR için primer dizaynı yaparken aşağıdaki linklerden sekansınızı girip sağındaki formu doldurarak yolladığınızda sekansınızı çoğaltan primer dizileri size otomatik olarak mail ile anında gönderilir.
http://www.zymoresearch.com/tools/bisulfite-primer-seeker
veya diğer bir öneri:
http://www.urogene.org/cgi-bin/methprimer/methprimer.cgi
1 ve 2 nolu yöntemler MSP PCR yöntemi olarak adlandırılmakta, MSP PCR primer disayn ederken dikkat edilmesi gerekenleri kısaca özetlersek;
Primer ler 26-32 baz arasında olmalıdır. Tm değeri 55-60 C olmalıdır.
En az 1 CpG site içermelidir. Bu bölge primerin 3 ucuna yakın olmalıdır.
Metile ve unmetile olarak 2 şer çift R ve F primer disayn edilecek. Bu primerlerin sekansı yapılırken, DNA nın bisülfit conversiyonu yapılmış sekansı dikkate alınacaktır.
Primer çiftleri Bisülfit conversiyonu yapılan DNA nın tek strantını (5---3 yönünde) çoğaltacak, önce reverse primer bağlanacak, reverse primeri tarafından sentezlenen DNA nın diğer strandına forward primer bağlanacak. DNA metile ise metile primer, unmetile ise unmetile primer bağlanacak.
Bisulfit sekans PCR da ise, CpG adacıkları çoğaltılacak bölgenin içinde kalacak şekilde, CpG adacığı içermeyen F ve R, 1 çift primer disayn edilmekte. Eğer bu mümkün değilse, CpG adacıkları primerin 5 ucuna yakın kalacak, eğer primerler CpG adacığı içeriyorsa metile ve unmetile olarak tasarlanacaktır.
Ya da bisülfit modifikasyonu yapmadan D5310 kodlu ürünle RT-PCR ile kantitative metilasyon oranını ölçebilirsiniz. Bu kitte standart, enzim, pcr miksi her şey mevcut . Sadece gen standart primerlerinizi ve DNA nızı eklemeniz yeterli. Elde edilen CT değerleri otomatik olarak metilasyon yüzdesine çevrilmekte.
BİSÜLFİT KONVERSİYONU YAPILAN DNA’NIN AMPLİFİKASYONU İÇİN KAPSAMLI KLAVUZ
Yıllar boyunca, bisülfit dönüşüm metodu, DNA metilasyonu analizi için en yaygın olarak kullanılan yöntem haline gelmiştir. Bu, bireysel bazların DNA metilasyonunu haritasını düzenlemek için en uygun ve etkili bir yöntemdir. Analiz tekniklerinin ilk adımı olan bisülfit dönüştürme işleminin anlaşılması, uygun şekilde yapılması için çok önemlidir.
Zymo Research’ün bilim adamları, müşterilerine destek olmak amacıyla, bisülfit dönüşümünün optimizasyonu ve çalışma prensibi için, olağanüstü zaman harcamışlardır. Günümüzde, bu işlem hakkında daha az soru varken, bu dönüşüme uğramış DNA’nın analizi bağlamındaki çeşitli uygulamalarda, daha birçok soru cevapsız kalmıştır. Bu kılavuzda, herhangi bir tecrübe seviyesindeki araştırmacıya yardımcı olacak, analiz sürecini etkileyebilecek etmenleri daha iyi anlamaya yönelik, göz önünde bulundurulması önemli olan noktalar ve faktörler vardır
BAŞARILI BİSÜLFAT DÖNÜŞÜMÜ AŞAMALARI İÇİN İPUÇLARI
DNA metilasyonu analizleri, bisülfit işlemlerinin hemen ardından başladığı için, öncelikle, DNA numunesinde dönüşüm sırasında neler olduğunu anlamak yararlı olacaktır.
Bisülfit dönüşümü, DNA numunesinin fiziksel ve kimyasal özelliklerini önemli ölçüde değiştirecek olan, nispeten sert bir işlemdir. İşlem boyunca; geniş, sabit çift iplikçikli molekül yapıdaki genomik DNA’lar; rastgele parçalanmış, tek iplik yapısındaki ürünlere dönüşür. Ek olarak, metilasyona uğramamış sitozin bazları, urasile dönüştürülür. Bu müdahaleler sonucunda, DNA artık, temel DNA’ya benzer yapıda değildir ve bir sürü onarımdan geçmiştir. Bu yüzden, sonraki deneysel prosedür aşamaları için, bazı ayarlamalar yapmak zorunda olacaksınız.
BİSÜLFAT DÖNÜŞTÜRÜLMÜŞ DNA’NIN KONTROL EDİLMESİ
Tıpkı diğer deneylerde olduğu gibi, daha ileri aşamalara geçmeden önce, işleme uğramış DNA numunesinin kalitesini ve miktarını değerlendirmek isteyeceksiniz. Bunu gerçekleştirmek için gerekli olan birkaç ortak yöntem şunlardır.
UV Spektrofotometre
Agaroz jel elektroforezi
Bu işleme uğramış malzeme ile çalışırken, aşağıda vurgulanmış bu yöntemlerin her biri için, uygun ayarlamaların yapılmasının gerekli olduğunu göz ardı etmeyin.
BİSÜLFAT DÖNÜŞTÜRÜLMÜŞ DNA’NIN UV ÜZERİNDEN BELİRLENMESİ
Spektrofotometre kullanılırken, dönüşümden geçmiş DNA, artık yapıca daha çok RNA’ya benziyor olacağından, 40 ng/µl için AB260nm= 1,0 değerini kullanın. İlk bakışta, pek çok araştırmacı, elde ettikleri ürün miktarının düşük gibi olduğuna kanaat getirecektir. Bu durumun hesaba katılabilir iki nedeni olabilir.
1. Eğer kullanılan DNA numunesi, kalitesiz ve bozulmuş ise, bisülfat ile müdahale işlemi sırasında ürün kaybına sebep olmuş olabilir.
2. Başlangıç DNA miktarının içerisinde, RNA kontaminasyonu olabilir. Bisülfat dönüşümü ve temizleme işlemi sırasında, örnekteki RNA, ortamdan uzaklaştırılacağı için, buna takiben yapılan ölçümde ürün miktarı düşük görünecektir. Her iki koşulda da endişe edilecek bir durum yoktur. Eğer bir sonraki aşama PCR olarak planlanıyorsa, elde edilen malzeme hala yeterli miktardadır. Kullanılacak DNA, RNA’dan arınmıştır ve çoğunlukla kusursuz sonuçlar verecektir.
Yüksek kalitedeki DNA ürünü, başarılı bisülfat dönüştürmesine iyi bir başlangıçtır. Zymo Research’ün Quick-DNA Universal Kit’i, herhangi bir örnek kaynağından, ultra-saf DNA elde edilmesinin, en kolay ve güvenilir yöntemidir.
BİSÜLFAT ÇEVRİLMİŞ DNA’NIN JEL ANALİZİ
Dönüştürülmüş DNA’nın agaroz jel ile analizi yapılırken, %2’lik jel ile 100bp marker kullanın. Ayrıca, DNA’yı görüntüleyebilmek için, numunenizden 100 ng’a kadar yükleme yapılması gerekli olabilir. Birçok araştırmacı, jellerinde ilk başta hiç bant görmedikleri zaman, endişelenirler. DNA’nın çoğu tek strand yapıda olacağından, bu normaldir. Bu sorunu gidermek için, jeli kısa bir süreliğine buz banyosu içinde serinletin. Bu sayede, tek iplikçikli moleküller arasında baz eşleşmesi meydana gelecek, bu eşleşmeler sırasında etidyum bromit aralara sıkışacak ve elde edilen ürünün aydınlanma yapmasını sağlayacaktır. Elde edilen DNA, genellikle 1500 bp den 100bp bant aralığında, smear olarak görünecektir.
Bisülfat dönüşümüne uğramış DNA’nın zorlukları – grafik- DNA’nın parçalanmış yapılar haline gelmesi ve sınırlı baz eşleşmeleri, bisülfat dönüştürmesinin takibini gözlemlemeyi zorlaştırır. Bilsülfatça dönüştürülmüş genomik insan DNA’sının 100bp’lik %2’lik agaroz jeldeki analizinin soğuk banyo içerisinde soğutulmasından önce (solda) ve sonra (sağda) görüntüsü.
BİSÜLFAT DÖNÜŞTÜRÜLMÜŞ DNA’NIN PCR TEMELLİ ANALİZİ
Bisülfat tabanlı metodların yelpazesi oldukça geniştir, fakat biz laboratuvarlarda en yaygın olarak kullanılanlar üzerinde yoğunlaşacağız.
Birçok sayıda bisülfat temelli analiz yaklaşımı PRC-amplifikasyonuna hizmet eder ve bunlardan en yaygın olarak kullanılanları aşağıdakilerdir.
Methylation Spesific PCR (MSP)
Bisulfite Sequencing
Bisulfite Pyrosequencing
Bu yöntemler arasında, hataya en eğilimli olan basamak, PCR basamağıdır. Yine, bisülfat çevrilmiş DNA’nın amplifikasyonu ile ilgili olan handikaplar, numunenin fiziksel niteliklerinin değişmiş olması gerçeğine bağlıdır. Bu değişiklikler şunlar gibidir.
İşlem görmüş DNA büyük ölçüde parçalanmış haldedir.
İplikler artık birbirlerini tamamlayıcı değildir.
Moleküllerin çoğu sitozin bileşimlerini kaybederek daha çok üç bazlı nükleik asitli yapılara benzemişlerdir.
Her ne kadar bu koşullar kolay bir PCR yapma deneyimine engel olsa da, birkaç defa yapılacak olan pratik sayesinde, örnekleri aşağıda sıralanmıştır, bu zorlu şablonun yarattığı etki azaltılabilir.
Optimize edilmiş primerlerin tasarlanması
“Hot start” polimerazının kullanılması
Anneling kondisyonlarının optimizasyonu
BİSÜLFAT PRİMER TASARIMLARININ OPTİMİZASYONU
Bisülfat amplikasyonu için primerlerin optimize edilmesi işlemi, ilk bakışta zorlu olarak görünebilir, fakat eğer, bazı ipuçlarını izlerseniz, nispeten hızlı bir şekilde başarılı sonuçlar almaya yönelik olan yolda olabilirsiniz. Uygulamanıza bağlı olarak, iki tip primer tasarlama yöntemi vardır. 1) Bisülfat PCR primerleri, bölge metilasyonu durumu ne olursa olsun, orayı çoğaltan primerlerdir. 2) Metilasyon özel primerleri (MSP), sadece ya metillenmiş ya da metillenmemiş hedef lokusu yükseltmeye yönelik tasarlanmışlardır.
Seçme Aracı: Bisulfite Primer Seeker Bisülfat dönüştürme teknolojisinde on yılı aşmış bir tecrübeye sahip olan Zymo Research, Bisulfite Primer Seeker ile bıktırıcı bisülfat-primer tasarım sürecini basitleştirmiştir. Özellikle CG bakımından zengin şablonlar için primer tasarlama yeteneğine sahip olması özelliği, bu programı diğer kullanabilir seçeneklerden ayrı bir yere koyar. Bisulfite Primer Seeker, sizin ilgili sıralamalarınızın içindeki farklı bölgeleri kapsayan amplikonlar için çoklu primer seçeneklerini desteklemesi, onu ayrıca bir adım öne çıkarmaktadır. Primer Dizaynı için Zymo Research web sitesine yönelmek için tıklayın..
BİSÜLFAT SEQUENCİNG PCR İÇİN PRİMER TASARIMI
Diğer PCR ayarlarında da olduğu gibi, bu senaryoda primerler, örneği çoğaltmak için kullanılır. Örnekler, en sıklıkla, DNA metilasyon durumunu belirleyecek olan başka yöntemler ile (örneğin bisülfat sıralama, kitle spektrofotometresi gibi) analiz edilecektir.
Normal PCR’daki 4 nükleotid bazdan oluşan şablonun aksine, bisülfat PCR primerleri, sitozin kaybı ile birlikte daha uzun olmaya ihtiyaç duyar. Primerler , yeterli spesifitede en az 26-30 bazdan oluşmuş olmalıdır. Ayrıca template çoğunlukla parçalanmış olacağından, 150-300bp arasındaki amplikon boyutunun hedeflenmesi tavsiye edilir.
Bisulfit sekans PCR da, CpG adacıkları çoğaltılacak bölgenin içinde kalacak şekilde, CpG adacığı içermeyen F ve R, 1 çift primer disayn edilmelidir. Eğer bu mümkün değilse, CpG adacıkları primerin 5 ucuna yakın kalacak, eğer primerler CpG adacığı içeriyorsa metile ve unmetile olarak tasarlanacaktır.
Primerleri tasarlarken, ilk olarak DNA’yı dönüştürmek, yani, bütün non-CpG sitozinlerini, urasillere dönüştürmek, iyi bir alıştırmadır. Template’in sadece tek bir iplikçiğinin, verilen primer set tarafından amplifie edileceğini unutmamak önemli bir noktadır. DNA iplikleri artık tamamlayıcı yapıda olmadığından, sadece reverse primer hedef DNA’ya bağlanacaktır. Forward primer, reverse primerden sentezlenen ikinci template bağlanacaktır.
Başarılı bir amplifikasyon için, genellikle 35-40 kadar döngü gerekmektedir.
METİLASYON SPESİFİK PCR (MSP) İÇİN PRİMER DİZAYNI
Bisülfat PCR primerleri aksine, MSP primerleri, bisulfit dönüştürülmüş DNA’nın yükseltilmesinde, çift fonksiyonlu olarak işlem yapar ve belirli CpG adacıklarındaki DNA metilasyonunu sorgular.
Yukarıdaki standart bisülfit çoğaltma yöntemlerinin gözlemlenmesine ek olarak, MSP primerleri, aşağıdaki hususlar göz önüne alınarak tasarlanmalıdır:
Primerler en az bir CpG bölgesi içermelidir.
CpG adacıkları primerlerin 3’ ucuna yakın olmalıdır.
Her bir amplikon için 2 çift primer gereklidir.
1. CpG bölgelerinde bir sitozin içeren methylated primer seti
2. CpG lokasyonlarında, sitozin yerine timin kullanan unmethylated primer seti
BİSÜLFİT PCR VE MSP PCR İÇİN PRİMER TASARIMININ AKIŞ DİYAGRAMI
A- Bisülfat müdahalesini takiben, DNA şablonunun çevrilmiş iki iplikçiği, artık bütünleyici değildir.
B- Bisülfat PCR primerleri, daha sonraki sekans ve amplikonun içindeki sitozinlerin analizi için tasarlanır. Primerlerdeki CpG bölgeleri, uzak tutulmalıdır veya primerin sitozin pozisyonundaki karma baz ile 5’ yönündeki bitiminde yerleştirilmelidir. Sıralama verisi, çoğunlukla, kapalı çemberlerin metillenmiş sitozinlerin pozisyonlarını, açık çemberlerin ise metilasyona uğramamış sitozinleri temsil ettiği, “lollipop” eğrisi ile gösterilir.
C- MSP PCR için olan primerler, belirli CpG bölgelerindeki metilasyon durumunu hedeflemek ve değerlendirmek için tasarlanır. Metilasyona uğramış (M) veya uğramamış (U) taslaklarının özgüllüğünü arttırmak için, primerlerin içindeki CpG siteleri, 3’ bitişinde konumlandırılmalıdır. Tamamen metilasyona uğramış veya uğramamış şablonlar, sadece takibi MSP’yi temsil eden primer setinden tek bir amplikon oluşturacaktır. Karışık metilasyona sahip olan örnekler, her iki primer tarafından çoğaltılacaktır.
Annealing Gradient for Primers used for Bisulfite PCR. Replicate bisulfite PCRs were incubated in a gradient thermal cycler using an annealing temperature gradient of 55 to 65oC (left to right). Equal volumes from each reaction were analyzed in a 2% agarose gel with a 100 bp DNA marker.
Epigenetik, DNA sekansını değiştirmeyip DNA, protein ve RNA’ların fonksiyonunun ve regulasyonunun değişimi ile sonuçlanan modifikasyonları içerir. Embriyo sürecinden itibaren epigenetik patern hücreye ve dokuya özgü olarak gelişmektedir...

Bakteri ve virüsler arasındaki en önemli farklardan biri hayatta kalmak ve çoğalmak için kullandıkları yöntemlerdir. Bakteriler DNA, ribozom, sitoplazma, hücre duvarı ve hücre zarına sahip tek hücreli canlılardır...

Ultra hassas kana özgü qPCR master mixleri kullanarak kanseri tespit edin

İdrar örneklerinden cinsel yolla bulaşan hastalıklar, idrar yolu enfeksiyonları, tropikal hastalıklar veya kanser testi için ideal

Transfüzyon için kullanılacak tüm kan, HIV, Hepatit B & C, HTLV, Frengi, Zika ve Batı Nil virüsü gibi bazı bulaşıcı hastalıkları için test edilir. Kan aktarımını güvenli tutmak için tarama çözümleri, enfeksiyonun çok erken aşamalarında patojenleri tespit edebilmelidir.

Quick-16S™ NGS Library Prep Kit, 16S rRNA amplifikasyonu için uç nokta PCR yerine gerçek zamanlı PCR kullanır, bu da PCR ürünlerinin doğrudan nicelleştirilmesine olanak tanır ve TapeStation® analizi veya jel elektroforezi gibi ek kitaplık niceleme analizine olan ihtiyacı ortadan kaldırır.

Quick-ITS Plus NGS Library Prep Kiti , yüksek verimli dizileme için ITS bölgesini hedefleyen en hızlı ve en basit NGS kütüphane hazırlığıdır. Otomasyon dostu protokol, özel olarak tasarlanmış primerler kullanılarak birleştirilmiş hedeflenen amplifikasyon ve barkod ekleme için tek bir qPCR/PCR kullanır.
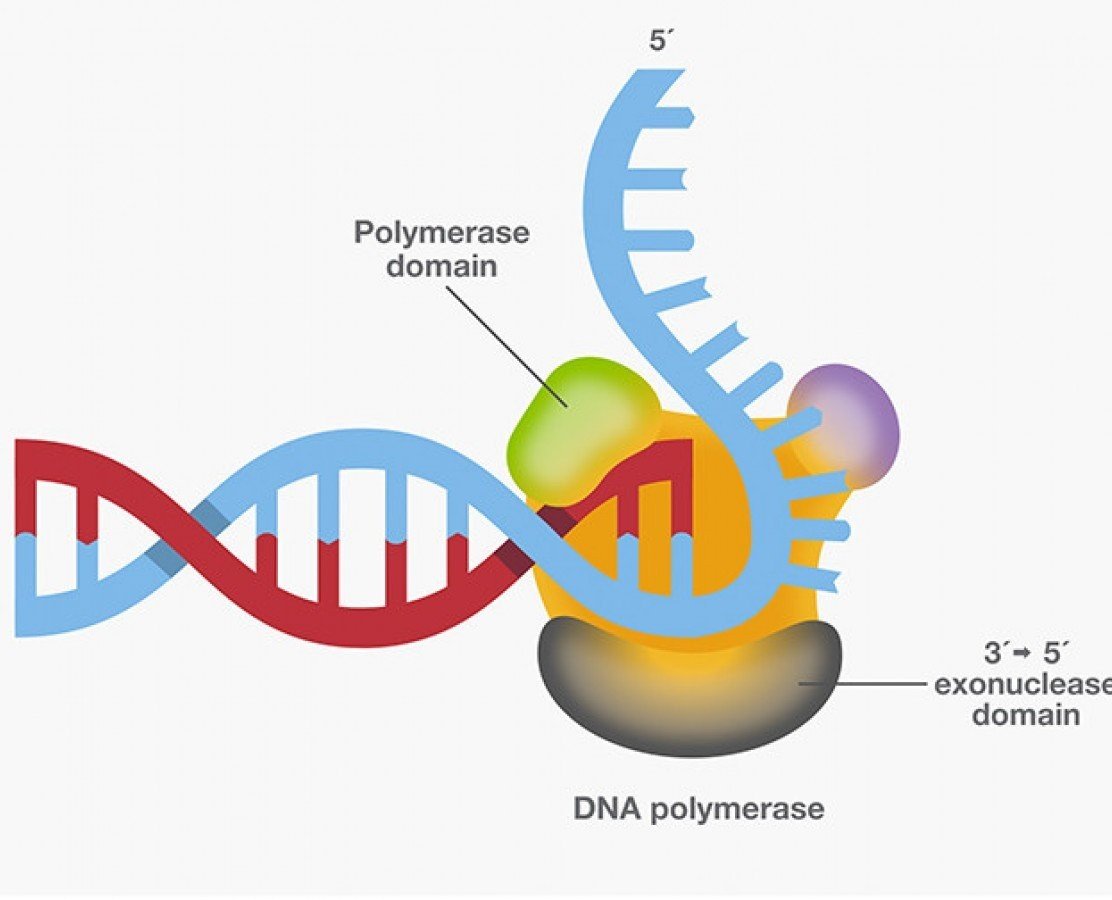
Başarılı PCR iki kritik bileşime bağlıdır. En iyi sonucu verecek şekilde optimize edilmiş reaksiyon buffer ve yüksek kaliteli thermostable DNA polymerase (Taq DNA polymerase gibi)….

DNA’nın metilasyon statüsünü belirlemek için sodium bisulfite treatment yöntemi gold standart olarak kabul edilmektedir.

Bir Metagenomik dalı olarak bilinen Mikrobiomik, her bir mikroorganizmanın tüm genomunun sekanslanmasıyla günümüzde moleküler biyolojiyi kökten değişime uğratmıştır. Kendi doğal ortamlarında mikroorganizmaların genomlarına direk ulaşılmasıyla birlikte metagenomik, çevresel çalışmalara biyomarker araştırmalarında olduğu kadar uygulanmış ve mikrobiyal çeşitlilik çalışmaları için yeni bir dönem başlatmıştır.

Gen anlatımı, DNA'nın protein yapmak için kullanıldığı ve daha sonra vücutta çeşitli önemli işlevleri yerine getirmeye devam ettiği süreçtir. Proteine örnek olarak bir enzim, hormon veya reseptör gösterilebilir. Gen ifadesi süreci aşağıdaki adımları içerir:
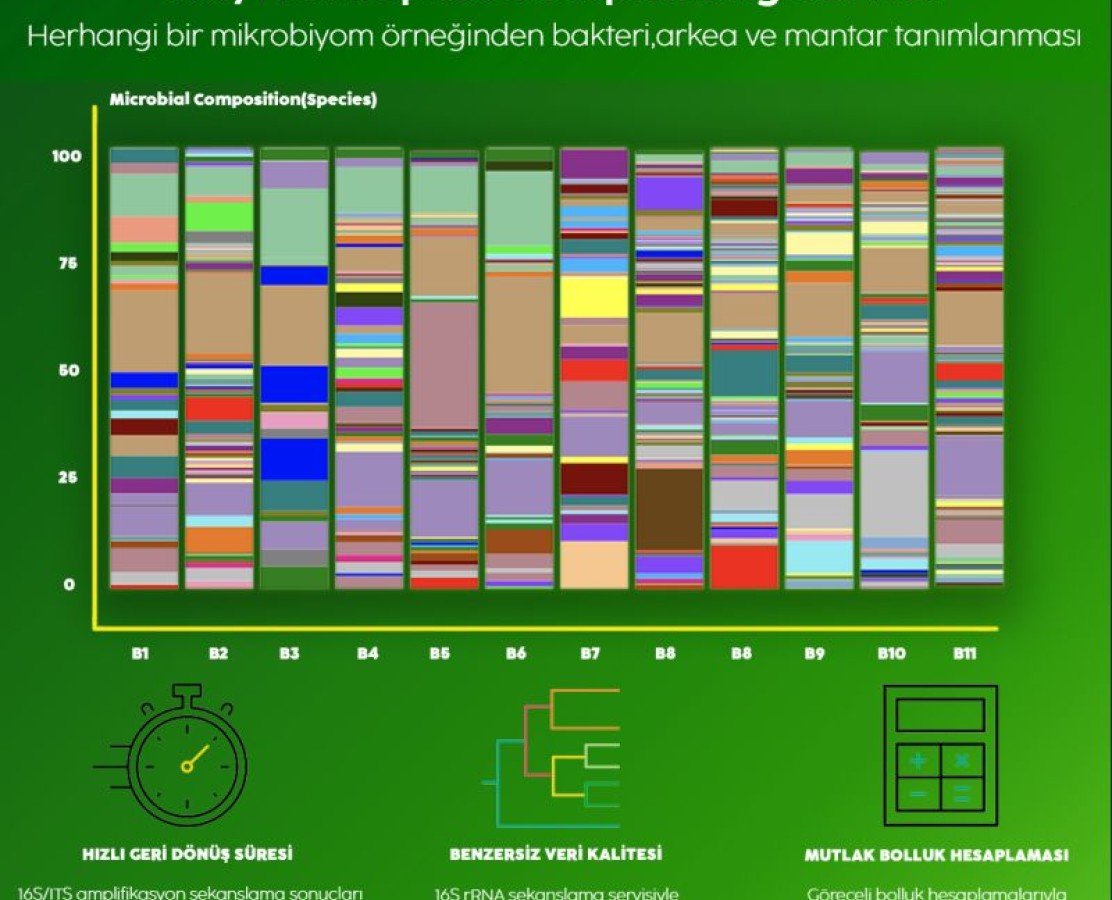
Bir Metagenomik dalı olarak bilinen Mikrobiomik, her bir mikroorganizmanın tüm genomunun sekanslanmasıyla günümüzde moleküler biyolojiyi kökten değişime uğratmıştır. Kendi doğal ortamlarında mikroorganizmaların genomlarına direk ulaşılmasıyla birlikte metagenomik, çevresel çalışmalara biyomarker araştırmalarında olduğu kadar uygulanmış ve mikrobiyal çeşitlilik çalışmaları için yeni bir dönem başlatmıştır.